Новости
Утверждаю
Руководитель Департамента
госсанэпиднадзора
Минздрава России
А.А.МОНИСОВ
30 декабря 1998 г. N МУ-287-113
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ДЕЗИНФЕКЦИИ, ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКЕ
И СТЕРИЛИЗАЦИИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
Методические указания разработаны:
Научно-исследовательским институтом дезинфектологии МЗ РФ;
Пермским областным центром ГКСЭН;
Пермским городским центром ГКСЭН;
Пермской городской дезинфекционной станцией;
Архангельским государственным медицинским институтом.
Авторы: И.М. Абрамова, Л.Г. Пантелеева, Л.С. Федорова, Н.В. Рамкова, Г.Н. Мельникова, Р.Л. Гутерман, Т.Н. Юшманова, Т.М. Лебедева, С.С. Николаева, В.В. Семериков, В.Н. Северюхин, И.С. Шарипова, Е.А. Каликова.
Методические указания предназначены для специалистов лечебно-профилактических учреждений (ЛПУ), работников дезинфекционных станций и центров Государственного санитарно-эпидемиологического надзора.
Ответственный за выпуск - канд. мед. наук В.В. Семериков.
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Дезинфекция, предстерилизационная очистка и стерилизация изделий медицинского назначения (далее - изделия) направлены на профилактику внутрибольничных инфекций у пациентов и персонала лечебно-профилактических учреждений (ЛПУ).
1.2. Дезинфекцию изделий проводят с целью уничтожения патогенных и условно-патогенных микроорганизмов - вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции), бактерий (включая микобактерии туберкулеза), грибов (включая грибы рода Кандида) - на изделиях медицинского назначения, а также в их каналах и полостях.
Дезинфекции подлежат все изделия после применения их у пациента. После дезинфекции изделия применяют по назначению или (при наличии показаний) подвергают предстерилизационной очистке и стерилизации.
1.3. Стерилизацию изделий проводят с целью умерщвления на изделиях или в изделиях микроорганизмов всех видов, в том числе споровых форм микроорганизмов. Стерилизации подлежат все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью в организме пациента или вводимой в него, инъекционными препаратами, а также изделия, которые в процессе эксплуатации контактируют со слизистой оболочкой и могут вызвать ее повреждение.
1.4. Изделия многократного применения, подлежащие стерилизации, перед стерилизацией подвергают предстерилизационной очистке.
Предстерилизационную очистку проводят с целью удаления с изделий белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов.
1.5. В качестве средств дезинфекции, предстерилизационной очистки и стерилизации используют только разрешенные в установленном порядке в Российской Федерации физические и химические средства.
1.6. При выборе средств следует учитывать рекомендации изготовителей изделий, касающиеся воздействия конкретных средств (из числа разрешенных в нашей стране для данной цели) на материалы этих изделий.
При проведении дезинфекции, предстерилизационной очистки и стерилизации допускается использование только того оборудования (установки, моечные машины, стерилизаторы и др.), которое разрешено в установленном порядке к промышленному выпуску и применению (в случае импортного оборудования - разрешенного к применению) в Российской Федерации.
1.7. Емкости с растворами дезинфицирующих, моющих и стерилизующих средств должны быть снабжены крышками, иметь четкие надписи с указанием названия средства, его концентрации, назначения, даты приготовления (для готовых к применению средств, разрешенных для многократного использования, указывают дату начала использования средства).
1.8. Рекомендации по дезинфекции, предстерилизационной очистке и стерилизации сложных по конструкции изделий (эндоскопы, медицинские инструменты к гибким эндоскопам и др.), а также дополнительные сведения, касающиеся различных аспектов указанных видов обработки изделий, более подробно изложены в ряде официальных инструктивно-методических документов, указанных в Приложении 1.
1.9. Перечень дезинфекционных средств и методических документов по их применению приведен в Приложении 2.
2. ДЕЗИНФЕКЦИЯ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
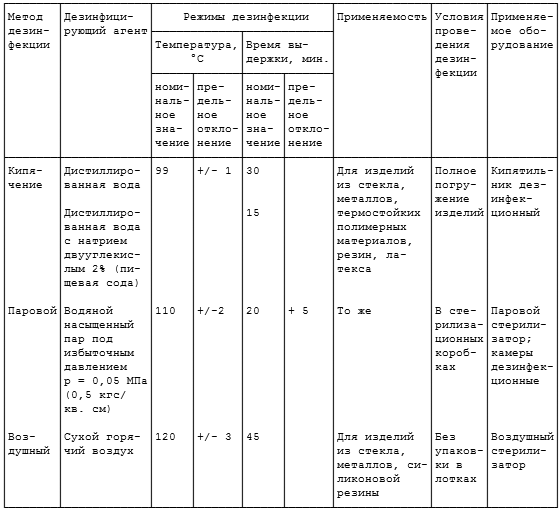
2.1. Дезинфекцию изделий осуществляют физическим (кипячение, водяной насыщенный пар под избыточным давлением, сухой горячий воздух) и химическим (использование растворов химических средств) методами.
Выбор метода дезинфекции зависит от особенностей изделия и его назначения.
2.2. Физический метод дезинфекции надежен, экологически чист и безопасен для персонала, поэтому в тех случаях, когда позволяют условия (оборудование, номенклатура изделий и т.д.), при проведении дезинфекции изделий предпочтение следует отдать этому методу.
2.3. Дезинфекцию с использованием физического метода выполняют:
способом кипячения в дистиллированной воде или в воде с добавлением натрия двууглекислого (сода пищевая);
паровым методом (в паровом стерилизаторе - автоклаве);
воздушным методом (в воздушном стерилизаторе).
2.3.1. Дезинфекции способом кипячения подвергают изделия из стекла, металлов, термостойких полимерных материалов и резин. Перед кипячением изделия очищают от органических загрязнений, промывая водопроводной водой. Отсчет времени дезинфекционной выдержки начинают с момента закипания воды.
2.3.2. Паровым методом дезинфицируют изделия из стекла, металлов, резин, латекса, термостойких полимерных материалов. Предварительная очистка изделий не требуется. Их складывают в стерилизационные коробки и помещают в паровой стерилизатор. Дезинфекция осуществляется воздействием водяного насыщенного пара под избыточным давлением.
2.3.3. Дезинфекцию воздушным методом изделий из стекла, металлов, силиконовой резины проводят без упаковки в воздушных стерилизаторах. Этим методом можно дезинфицировать только изделия, не загрязненные органическими веществами.
Режимы дезинфекции физическим методом представлены в таблице 2.1.
Таблица 2.1
ДЕЗИНФЕКЦИЯ ФИЗИЧЕСКИМИ МЕТОДАМИ
2.4. Дезинфекцию с использованием химических средств проводят способом погружения изделий в раствор в специальных емкостях из стекла, пластмасс или покрытых эмалью без повреждений. Наиболее удобно применение специальных контейнеров, в которых изделия размещают на специальных перфорированных решетках. Разъемные изделия дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором.
Для изделий и их частей, не соприкасающихся непосредственно с пациентом, может быть использован способ двукратного протирания салфеткой из бязи или марли, смоченной в растворе дезинфицирующего средства. Способом протирания не рекомендуется применять средства, содержащие альдегиды (Глутарал, Глутарал-Н, Сайдекс, Гигасепт ФФ, Бианол, формалин и др.), а также Дезоксон-1 и Дезоксон-4 во избежание побочного токсического эффекта.
2.5. Для дезинфекции изделий разрешены к применению дезинфицирующие средства отечественного и зарубежного производства из следующих основных химических групп: хлорсодержащие средства, средства на основе перекиси водорода, на основе спиртов, альдегидов, катионных поверхностно-активных веществ.
2.6. Более щадящим действием по отношению к материалам, из которых изготавливаются медицинские изделия, обладают альдегидсодержащие средства: Глутарал, Глутарал-Н, Бианол, Аламинол, Сайдекс, Гигасепт ФФ, Лизоформин-3000, Дезоформ, Альдазан-2000, Секусепт-Форте и др. Эти средства рекомендованы для изделий из стекла, металлов, резин, полимерных материалов, в том числе термолабильных.
Недостатком многих средств из этой группы является их способность фиксировать органические загрязнения на поверхности и в каналах изделий. Во избежание этого изделия необходимо отмыть от загрязнений с соблюдением противоэпидемических мер, а затем дезинфицировать, о чем есть сведения в методических указаниях по применению средства.
2.7. Применение спирта этилового синтетического ректификованного рекомендовано только для дезинфекции инструментов из металлов. Для дезинфекции изделий не только из металлов, но и других материалов разрешены к применению средства на основе спиртов и катионных ПАВ: Гибитан, Велтосепт.
Средства, содержащие спирты, также обладают свойством фиксировать загрязнения органического происхождения, что обусловливает необходимость предварительного отмывания загрязненных изделий перед дезинфекцией с соблюдением противоэпидемических мер.
2.8. Хлорсодержащие средства (Хлорамин Б или ХБ, ДП-2, Пресепт, Клорсепт и др.), а также большинство средств на основе перекиси водорода (перекись водорода с 0,5% моющего средства, Пероксимед, ПВК и др.) предназначены для дезинфекции изделий из коррозионностойких металлов, а также других материалов - резин, пластмасс, стекла.
Для дезинфекции изделий медицинского назначения допускается применение перекиси водорода медицинской и технической (марки А и Б).
2.9. Дезинфицирующие средства с моющим действием, такие как Пероксимед, нейтральные анолиты, Лизетол АФ, Виркон и другие, могут быть использованы для дезинфекции изделий медицинского назначения и предстерилизационной очистки на одном этапе обработки.
2.10. Дезинфекцию изделий химическим методом осуществляют одним из средств по режимам, представленным в таблице 2.2.
Таблица 2.2
ДЕЗИНФЕКЦИЯ ХИМИЧЕСКИМ
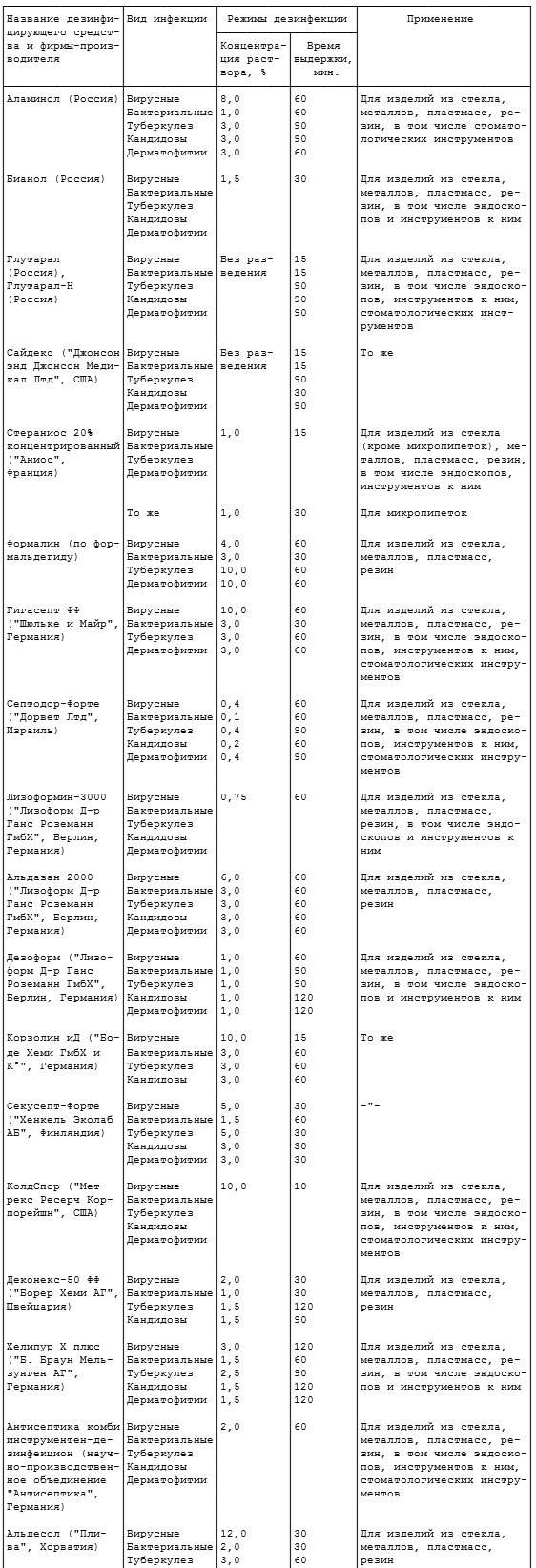
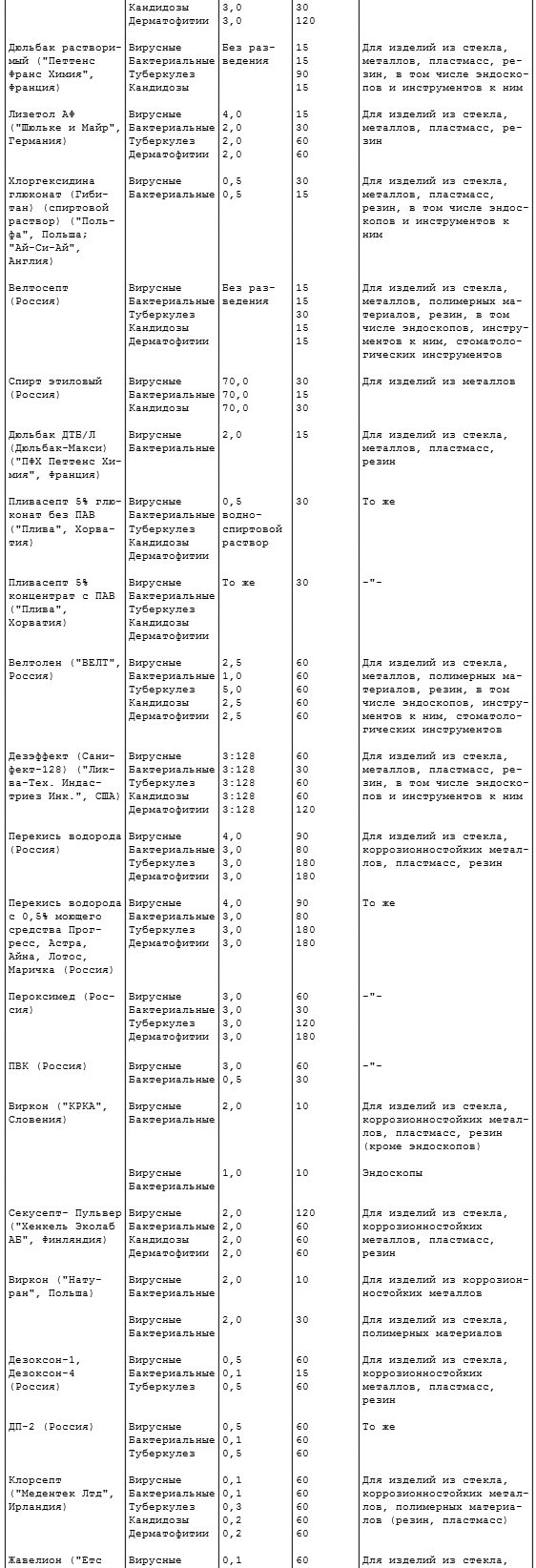
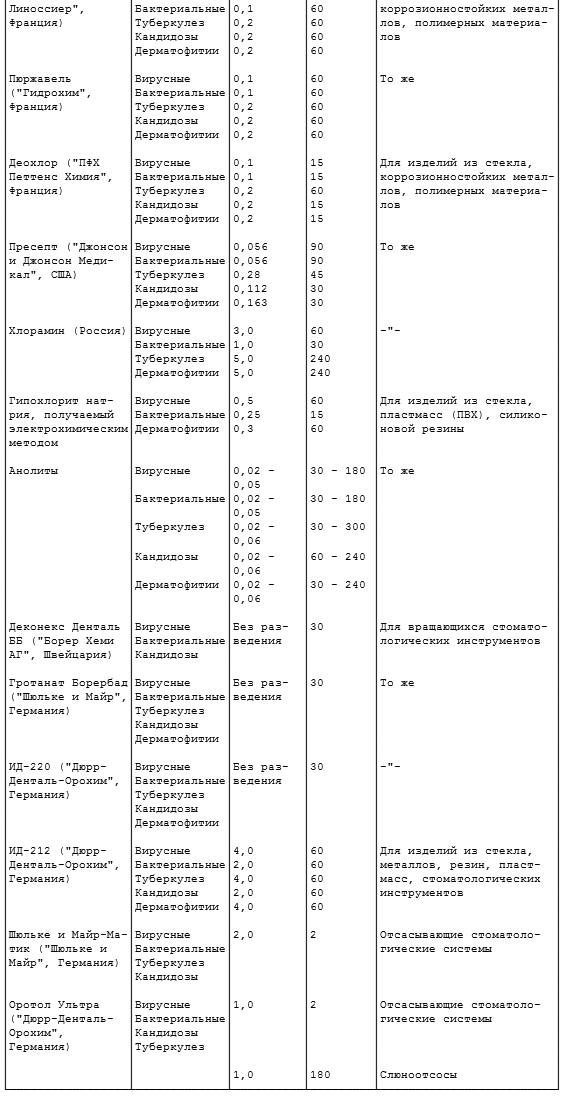
Примечание. Концентрации рабочих растворов средств Глутарал, Глутарал-Н, формалин, хлоргексидина глюконат (Гибитан), спирт этиловый, Пливасепт 5% глюконат без ПАВ, Пливасепт 5% глюконат с ПАВ, перекись водорода с моющим средством, Пероксимед, ПВК, Дезоксон-1 и Дезоксон-4, Клорсепт, Жавелион, Пюржавель, Деохлор, Пресепт, гипохлорит натрия, анолиты приведены по ДВ, остальных средств - по препарату.
2.10.1. Режимы дезинфекции химическим методом даны в пяти вариантах: 1 (первая строка) - при вирусных гепатитах, ВИЧ-инфекции, энтеровирусных, ротавирусных инфекциях; 2 (вторая строка) - следует применять для предупреждения гнойных заболеваний, кишечных и капельных инфекций бактериальной этиологии, острых респираторных вирусных инфекций (грипп, аденовирусные заболевания и др.); 3 (третья строка) - при туберкулезе; 4 (четвертая строка) - при кандидозах; 5 (пятая строка) - при дерматофитиях. В тех случаях, когда в таблице приведен один вариант режима (средства КолдСпор, Деконекс Денталь ББ и др.), он распространяется на все виды возбудителей.
2.10.2. При отсутствии обоснованных показаний к проведению дезинфекции по режимам для инфекций бактериальной этиологии (исключая туберкулез) дезинфекцию проводят по режимам для вирусных инфекций.
2.10.3. Для дезинфекции эндоскопов могут быть использованы следующие дезинфицирующие средства: Бианол, Глутарал, Глутарал-Н, Сайдекс, Гигасепт ФФ, Септодор-Форте, Велтолен, Велтосепт и др. Подробно методика проведения дезинфекции эндоскопов изложена в методических указаниях (Приложение 1).
2.11. По окончании дезинфекционной выдержки изделия промывают проточной водой. Оставшиеся загрязнения тщательно отмывают с помощью механических средств (ерши, щетки, салфетки марлевые или бязевые и др.).
2.12. После дезинфекции изделия используют по назначению или (при наличии показаний) подвергают дальнейшей предстерилизационной очистке и стерилизации.
2.13. Дезинфекция изделий медицинского назначения в стоматологии.
2.13.1. Изделия медицинского назначения, применяемые в стоматологии, отличаются разнообразием по конструкции, составу входящих в них материалов, назначению и поэтому требуют тщательного выбора метода и средства дезинфекции.
2.13.2. Стоматологические изделия, выдерживающие воздействие высоких температур, дезинфицируют кипячением или воздействием сухого горячего воздуха.
2.13.3. Для дезинфекции стоматологических инструментов рекомендованы средства на основе альдегидов, спиртов, катионных поверхностно-активных веществ, содержащих, кроме действующих веществ, анионные и неионогенные ПАВ, ингибиторы коррозии и другие компоненты (Деконекс Денталь ББ, Гротанат Борербад, ИД-220, ИД-212, Аламинол, Сайдекс, Септодор-Форте, Санифект-128, Велтолен, Велтосепт и др.).
2.13.4. Средства "Шюльке и Майр-Матик" и "Оротол Ультра" применяют для дезинфекции стоматологических отсасывающих систем. Подробные сведения об использовании этих средств имеются в методических указаниях по их применению.
2.13.5. Дезинфекцию стоматологических оттисков осуществляют после их предварительного промывания водой с соблюдением мер противоэпидемической защиты. Во время промывания оттисков следует избегать разбрызгивания смывных вод.
2.13.6. Дезинфекцию оттисков проводят способом погружения в раствор дезинфицирующего средства. Выбор дезинфицирующего средства обусловлен видом оттискного материала. Набор дезинфицирующих средств для обеззараживания оттисков из силиконовых материалов шире, чем для оттисков из альгинатных материалов.
2.13.7. Режимы дезинфекции оттисков представлены в таблице 2.3, они обеспечивают обеззараживание их от вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции), бактерий, грибов рода Кандида.
Таблица 2.3
РЕЖИМЫ ДЕЗИНФЕКЦИИ СТОМАТОЛОГИЧЕСКИХ ОТТИСКОВ
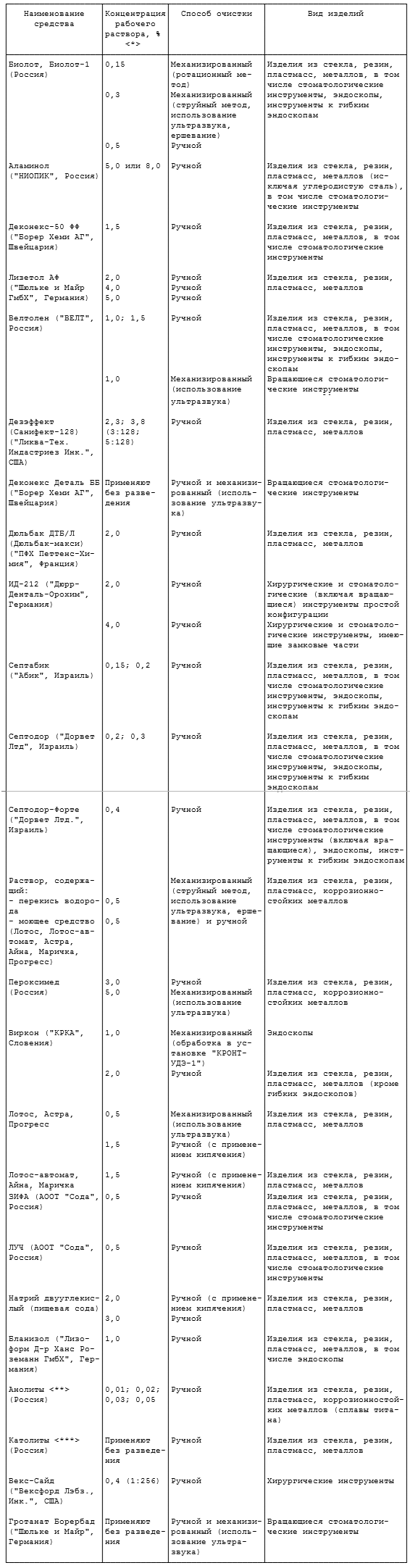
Примечание. Концентрация дезинфицирующих растворов приведена по ДВ.
2.13.8. После дезинфекции оттиски промывают водой для удаления остатков дезинфицирующего средства.
2.14. Контроль качества дезинфекции изделий медицинского назначения проводят в соответствии с изложенным в Приложении 3.
3. ПРЕДСТЕРИЛИЗАЦИОННАЯ ОЧИСТКА
3.1. Предстерилизационную очистку изделий медицинского назначения осуществляют после их дезинфекции и последующего отмывания остатков дезинфицирующих средств проточной питьевой водой (п. 2.11).
Предстерилизационную очистку лигатурного шовного материала (нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные) в ЛПУ не проводят.
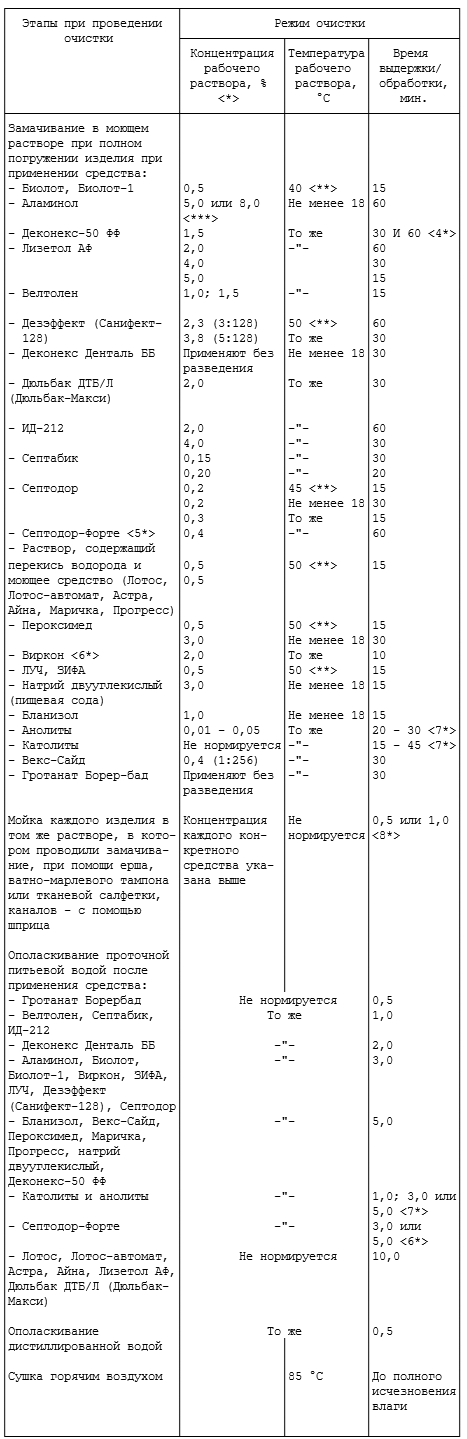
3.2. Для предстерилизационной очистки используют средства, указанные в таблице 3.1, в том числе электрохимически активированные растворы (католиты, анолиты), вырабатываемые в диафрагменных электрохимических установках, разрешенных к промышленному выпуску в установленном порядке.
Раствор, содержащий перекись водорода и моющее средство (Лотос, Лотос-автомат, Астра, Айна, Маричка, Прогресс), готовят в условиях ЛПУ, применяя перекись водорода медицинскую или техническую (марки А и Б). Для снижения коррозионного действия моющих растворов, содержащих перекись водорода с моющим средством "Лотос" и "Лотос-автомат", целесообразно использовать ингибитор коррозии - 0,14% олеата натрия.
Таблица 3.1
СРЕДСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКИ
--------------------------------
<*> Концентрация перекиси водорода, растворов средства "Пероксимед", а также анолитов приведена по действующему веществу, остальных средств - по препарату, концентрация средств "Дезэффект" ("Санифект-128") и "Векс-Сайд" дополнительно выражена соотношением долей концентрата средства и добавляемой воды.
<**> Электрохимически активированные растворы с pH от 5,5 до 8,4, в зависимости от типа анолита ("нейтральный анолит", "нейтральный анолит АНК"), вырабатываемые в установках "СТЭЛ-МТ-1", "СТЭЛ-4Н-60-01", "СТЭЛ-4Н-60-02", "СТЭЛ-10Н-120-01", применяют без разведения. Конкретные концентрации анолита приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
<***> Электрохимически активированные растворы с pH от 9,0 до 12,0, вырабатываемые в установках "ЭХА-30", "СТЭЛ-10АК-120-01", "СТЭЛ-МТ-2", "УМЭМ", применяют без разведения.
3.3. Предстерилизационную очистку проводят ручным или механизированным (с помощью специального оборудования) способом.
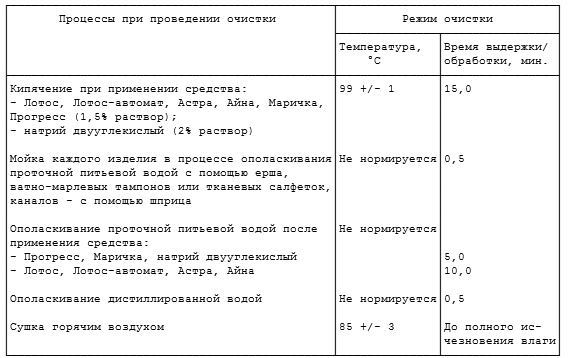
Предстерилизационную очистку ручным способом осуществляют в соответствии с таблицами 3.2 и 3.3, используя емкости из пластмасс, стекла или покрытых эмалью (без повреждений).
Методика проведения предстерилизационной очистки механизированным способом должна соответствовать инструкции по эксплуатации, прилагаемой к конкретному оборудованию.
Таблица 3.2
ПРЕДСТЕРИЛИЗАЦИОНИАЯ ОЧИСТКА РУЧНЫМ СПОСОБОМ
С ПРИМЕНЕНИЕМ ЗАМАЧИВАНИЯ В МОЮЩЕМ РАСТВОРЕ
--------------------------------
<*> Концентрация перекиси водорода, растворов средства "Пероксимед", а также анолитов приведена по действующему веществу, остальных средств - по препарату, концентрация средств "Дезэффект" ("Санифект-128") и "Векс-Сайд" дополнительно выражена соотношением долей концентрата средства и добавляемой воды.
<**> Температура раствора в процессе мойки не поддерживается.
<***> Используемая концентрация рабочего раствора средства "Аламинол" зависит от конструктивных особенностей изделий, указана в методических указаниях по применению средства.
<4*> Время выдержки зависит от особенностей обрабатываемых изделий и указано в методических указаниях по применению данного средства.
<5*> При применении средства "Септодор-Форте" замачивание изделий проводят после их предварительной очистки в этом же растворе.
<6*> При применении средства "Виркон" замачивание изделий в его 2% рабочем растворе проводят после предварительной очистки изделий от видимых загрязнений в 0,5% растворе этого же средства.
<7*> Время выдержки приведено в методических указаниях по применению католитов и анолитов, вырабатываемых конкретными установками.
<8*> В течение 1 мин. осуществляют мойку изделий средствами "Векс-Сайд" и "Септодор-Форте", а также мойку сложных изделий, имеющих каналы или замковые части, средствами "Бланизол", "Велтолен", "Виркон", "Пероксимед", "Септабик", "Септодор", "ИД-212", "Деконекс-50 ФФ"; во всех остальных случаях мойку каждого изделия осуществляют в течение 0,5 мин.
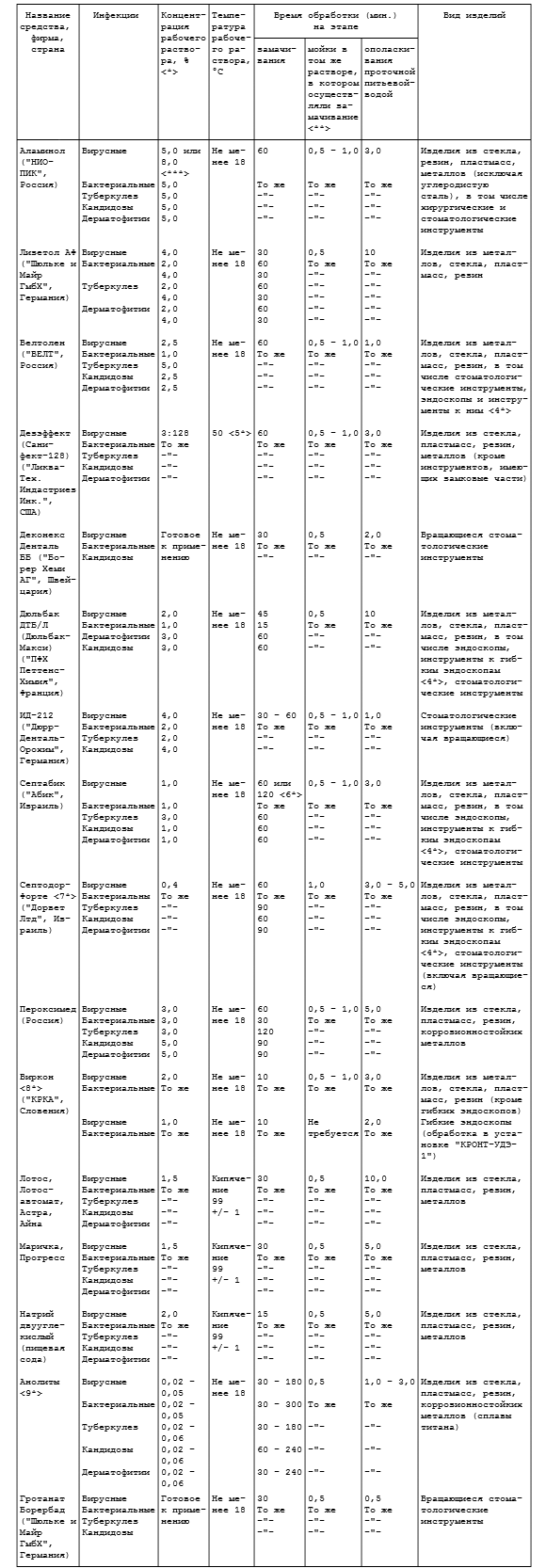
Таблица 3.3
ПРЕДСТЕРИЛИЗАЦИОННАЯ ОЧИСТКА РУЧНЫМ СПОСОБОМ
С ПРИМЕНЕНИЕМ КИПЯЧЕНИЯ
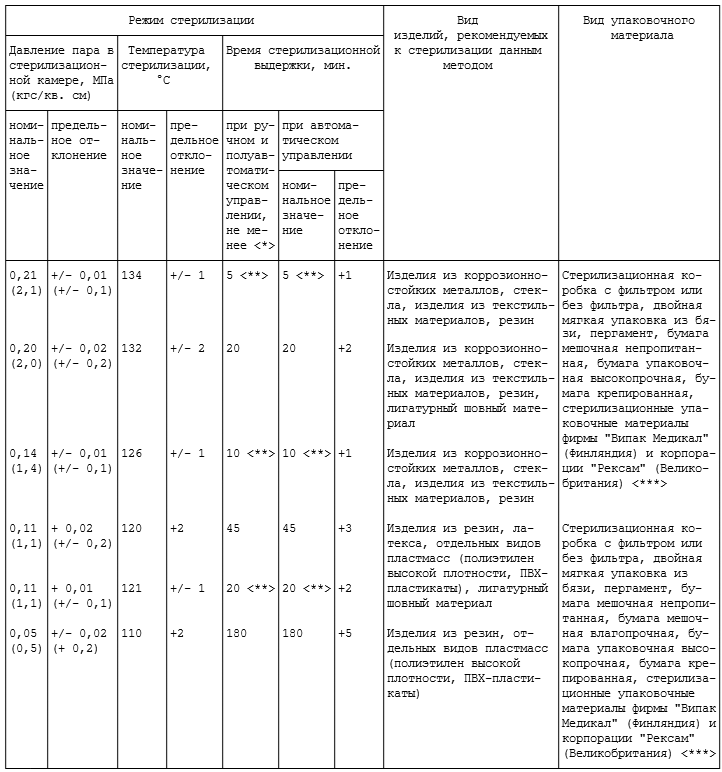
.4. При наличии у средства, наряду с моющими, также и антимикробных свойств (в том числе обязательно в отношении возбудителей парентеральных вирусных гепатитов и ВИЧ-инфекции) предстерилизационная очистка изделий на этапе замачивания или кипячения в растворе может быть совмещена с их дезинфекцией в соответствии с таблицей 3.4.
Таблица 3.4
ДЕЗИНФЕКЦИЯ И ПРЕДСТЕРИЛИЗАЦИОННАЯ ОЧИСТКА,
СОВМЕЩЕННЫЕ В ОДНОМ ПРОЦЕССЕ
--------------------------------
<*> Концентрация растворов средства "Пероксимед", а также анолитов приведена по действующему веществу, остальных средств - по препарату, концентрация средств "Дезэффект" ("Санифект-128") и "Векс-Сайд" дополнительно выражена соотношением долей концентрата средства и добавляемой воды.
<**> Мойку каждого изделия осуществляют с помощью ерша, ватно-марлевого тампона или тканевой салфетки; каналы изделий промывают с помощью шприца. В течение 1 мин. осуществляют мойку сложных изделий, имеющих каналы или замковые части, средствами "Бланизол Векс-Сайд", "Велтолен", "Виркон", "Пероксимед", "Септабик", "Септодор", "Септодор-Форте", во всех остальных случаях мойку каждого изделия осуществляют в течение 0,5 мин. При применении растворов моющих средств ("Лотос", "Лотос-автомат", "Астра", "Айна", "Маричка", "Прогресс"), а также натрия двууглекислого мойку изделий после кипячения осуществляют в процессе их ополаскивания проточной питьевой водой.
<***> Используемая концентрация рабочего раствора средства "Аламинол" зависит от конструктивных особенностей изделий.
<4*> Время обработки эндоскопов и медицинских инструментов к гибким эндоскопам на этапах мойки в растворах средств и ополаскивания проточной водой указано в методических указаниях по применению конкретного средства.
<5*> Температуру раствора в процессе мойки не поддерживают.
<6*> Время замачивания 120 мин. указано для изделий из резин.
<7*> При применении средства "Септодор-Форте" замачивание изделий проводят после предварительной их очистки в этом же растворе.
<8*> При применении средства "Виркон" замачивание изделий в его 2% рабочем растворе проводят после предварительной очистки изделий от видимых загрязнений в 0,5% растворе этого же средства.
<9*> Электрохимически активированные растворы с pH от 5,5 до 8,4 в зависимости от типа анолита ("нейтральный анолит", "нейтральный анолит АНК"), вырабатываемые в установках "СТЭЛ-МТ-1", "СТЭЛ-4Н-60-01", "СТЭЛ-4Н-60-02", "СТЭЛ-10Н-120-01", применяют без разведения. Конкретные концентрации анолитов и время выдержки приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
3.5. Разъемные изделия подвергают предстерилизационной очистке в разобранном виде.
При замачивании или кипячении в моющем растворе изделия полностью погружают в раствор моющего средства, заполняя им каналы и полости изделий.
Мойку изделий осуществляют с помощью ерша, ватно-марлевых тампонов, тканевых салфеток; каналы изделий промывают с помощью шприца. Использование ерша при очистке резиновых изделий не допускается.
3.6. Для предстерилизационной очистки растворы средств "Биолот", "Биолот-1", "Лизетол АФ", "Бланизол", "Пероксимед", "Септодор", "Векс-Сайд", а также средство "Гротанат Борербад", католиты и анолиты используют однократно; растворы средств "Луч", "Зифа", "Дюльбак ДТБ/Л" ("Дюльбак-Макси") - двукратно.
Растворы остальных средств допускается применять до загрязнения (появление первых признаков изменения внешнего вида), но не более чем в течение времени, указанного в методическом документе по применению конкретного средства.
При применении растворов, содержащих перекись водорода с моющим средством, растворов моющих средств "Лотос", "Лотос-автомат", "Астра", "Айна", "Маричка", "Прогресс", а также натрия двууглекислого, неизмененный раствор можно использовать до шести раз в течение рабочей смены.
3.7. Сушку изделий из натурального латекса проводят в соответствии с режимом, указанным в инструкциях по применению этих изделий.
Сушку изделий, имеющих оптические детали, проводят путем протирания чистой тканевой салфеткой и просушивания при комнатной температуре.
3.8. Контроль качества предстерилизационной очистки изделий проводят в соответствии с изложенным в Приложении 4.
4. СТЕРИЛИЗАЦИЯ
4.1. Стерилизацию изделий медицинского назначения проводят с целью умерщвления на них всех патогенных и непатогенных микроорганизмов, в том числе их споровых форм.
4.2. Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) и химическими (применение растворов химических средств, газовый) методами, указанными в таблицах 4.1, 4.3 - 4.6. Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий.
При стерилизации паровым, воздушным и газовым методами изделия, как правило, стерилизуют упакованными в стерилизационные упаковочные материалы; при паровом методе, кроме того, используют стерилизационные коробки без фильтров и с фильтрами (табл. 4.1, 4.3, 4.5).
Могут быть использованы только упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению (в случае импортных материалов - разрешенные к применению) в Российской Федерации.
При воздушном методе, а также в отдельных случаях при паровом и газовом методах, допускается стерилизация инструментов в неупакованном виде (в открытых лотках).
4.3. Паровой метод стерилизации.
4.3.1. При паровом методе стерилизации стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/кв. см) - 0,21 МПа (2,1 кгс/кв. см), температурой 110 - 135 °C; стерилизацию осуществляют в паровых стерилизаторах (автоклавах).
4.3.2. Паровым методом стерилизуют общие хирургические и специальные инструменты, детали приборов и аппаратов из коррозионностойких металлов, стекла, шприцы с пометкой 200 °C, хирургическое белье, перевязочный и шовный материал, изделия из резины (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс (табл. 4.1).
4.3.3. Стерилизационные коробки (биксы) не являются упаковкой для хранения простерилизованных изделий, но если эти изделия хранятся в коробках в течение времени, указанного в таблице 4.1, допускается использовать такие изделия по назначению.
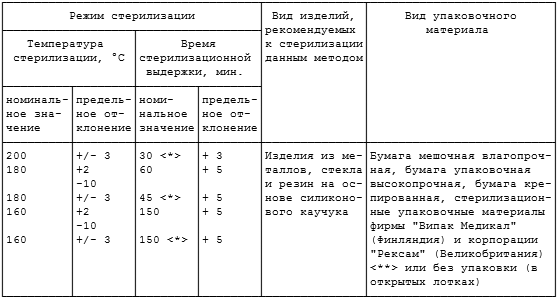
4.3.4. Хирургическое белье, перевязочный материал укладывают в стерилизационные коробки параллельно движению пара. Норма загрузки стерилизационных коробок хирургическим бельем и перевязочным материалом представлена в таблице 4.2.
4.3.5. Резиновые перчатки перед стерилизацией пересыпают внутри и снаружи тальком для предохранения их от склеивания. Между перчатками прокладывают марлю или бумагу, каждую пару перчаток заворачивают отдельно в марлю или бумагу и в таком виде помещают в стерилизационную коробку или в другую упаковку. В целях уменьшения неблагоприятного воздействия пара резиновые перчатки, как и другие изделия из резины, стерилизуют при температуре 120 - 122 °C.
4.3.6. Паровым методом стерилизуют лигатурный шовный материал: нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные (далее - лигатурный шовный материал).
Лигатурный шовный материал готовят к стерилизации в виде косичек, мотков, наматывая на катушки, стеклянные палочки и т.д.
Подготовленный лигатурный шовный материал заворачивают в два слоя упаковочного материала (при размещении в стерилизационной коробке - в один слой упаковочного материала) в количестве, рассчитанном на одну операцию. На упаковке отмечают вид шовного материала и его номер.
Нити хирургические капроновые крученые стерилизуют паром только при температуре 120 - 122 °C; лигатурный шовный материал других перечисленных видов допускается стерилизовать, кроме того, при температуре 130 - 134 °C.
Лигатурный шовный материал хранят в той же упаковке, в которой он был простерилизован, в специальных шкафах для стерильных изделий. Неиспользованный стерильный лигатурный шовный материал в случае нарушения условий или истечения срока хранения может быть повторно (еще лишь один раз) простерилизован паровым методом при температуре 120 - 122 °C.
4.4. Воздушный метод стерилизации.
4.4.1. При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 160 и 180 °C; стерилизацию осуществляют в воздушных стерилизаторах.
4.4.2. Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из коррозионнонестойких металлов, шприцы с пометкой 200 °C, инъекционные иглы, изделия из силиконовой резины (табл. 4.3).
4.4.3. Перед стерилизацией воздушным методом изделия после предстерилизационной очистки обязательно высушивают в сушильном шкафу при температуре 85 °C до исчезновения видимой влаги.
4.4.4. Качество стерилизации воздушным методом зависит от равномерности распределения горячего воздуха в стерилизационной камере, что достигается правильной загрузкой стерилизатора. Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемому изделию.
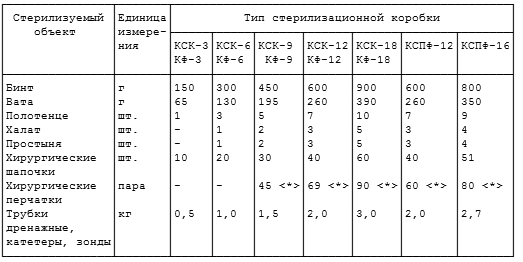
Таблица 4.1
СТЕРИЛИЗАЦИЯ ПАРОВЫМ МЕТОДОМ
(ВОДЯНОЙ НАСЫЩЕННЫЙ ПАР ПОД ИЗБЫТОЧНЫМ ДАВЛЕНИЕМ)
--------------------------------
<*> Время стерилизационной выдержки, соответствующее значению температуры стерилизации с учетом предельных отклонений температуры в загруженной стерилизационной камере, указано в паспорте на конкретную модель стерилизатора.
<**> Приведено время стерилизационной выдержки, которое рекомендовано в паровых стерилизаторах нового поколения с предельным отклонением температуры в стерилизационной камере +/- 1 °C от номинального значения.
<***> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации паровым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм.
Срок сохранения стерильности изделий, простерилизованных в стерилизационной коробке без фильтра, в двойной мягкой упаковке - 3 суток, в пергаменте, бумаге мешочной непропитанной, бумаге мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром - 20 суток.
Кратность использования пергамента, бумаги мешочной непропитанной, бумаги мешочной влагопрочной и бумаги крепированной - 2 раза, бумаги упаковочной высокопрочной - 3 раза.
Таблица 4.2
НОРМЫ ЗАГРУЗКИ СТЕРИЛИЗАЦИОННЫХ
КОРОБОК ИЗДЕЛИЯМИ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
(ЗАГРУЗКА ИЗДЕЛИЙ ОДНОГО НАИМЕНОВАНИЯ)
--------------------------------
<*> Приведено время стерилизационной выдержки для воздушных стерилизаторов нового поколения с предельными отклонениями температуры в стерилизационной камере +/- 3 °C от номинального значения.
<**> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации воздушным методом, а также сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок.
Срок сохранения стерильности изделий, простерилизованных в бумаге мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, - 20 суток. Кратность использования бумаги мешочной влагопрочной, бумаги крепированной - 2 раза, бумаги упаковочной высокопрочной - 3 раза.
Изделия, простерилизованные без упаковки, помещают на "стерильный стол" и используют в течение одной рабочей смены.
4.4.5. Стерилизуемые изделия, равномерно распределяя, укладывают горизонтально поперек пазов кассет (полок); не допускается перекрывать продувочные окна и решетки вентиляции. Объемные изделия следует класть на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха. При загрузке необходимо следить за тем чтобы стерилизуемые изделия не попадали в зону вращения крыльчатки. Загрузку и выгрузку изделий проводят при температуре в стерилизационной камере 40 - 50 °C.
4.4.6. Изделия стерилизуют завернутыми в стерилизационные упаковочные материалы. Шприцы стерилизуют в разобранном виде.
Во время стерилизации металлических инструментов без упаковки их располагают так, чтобы они не касались друг друга.
4.5. В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные, дрильборы, а также рабочие части гладилок, экскаваторов, зондов и др.). Изделия стерилизуют в неупакованном виде по режимам, указанным в инструкции по эксплуатации конкретного стерилизатора, разрешенного для применения.
После стерилизации инструменты используют сразу по назначению.
4.6. Стерилизация растворами химических средств.
4.6.1. Стерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода, 0,9% раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами.
Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть в тех случаях, когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации. Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходим хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия.
4.6.2. Для стерилизации растворами химических средств используют средства, указанные в таблице 4.4, в том числе электрохимически активированные растворы, вырабатываемые в диафрагменных электрохимических установках типа "СТЭЛ", а также вырабатываемые другими установками, разрешенными к выпуску, согласно инструктивно-методическим документам, утвержденным в установленном порядке в Российской Федерации.
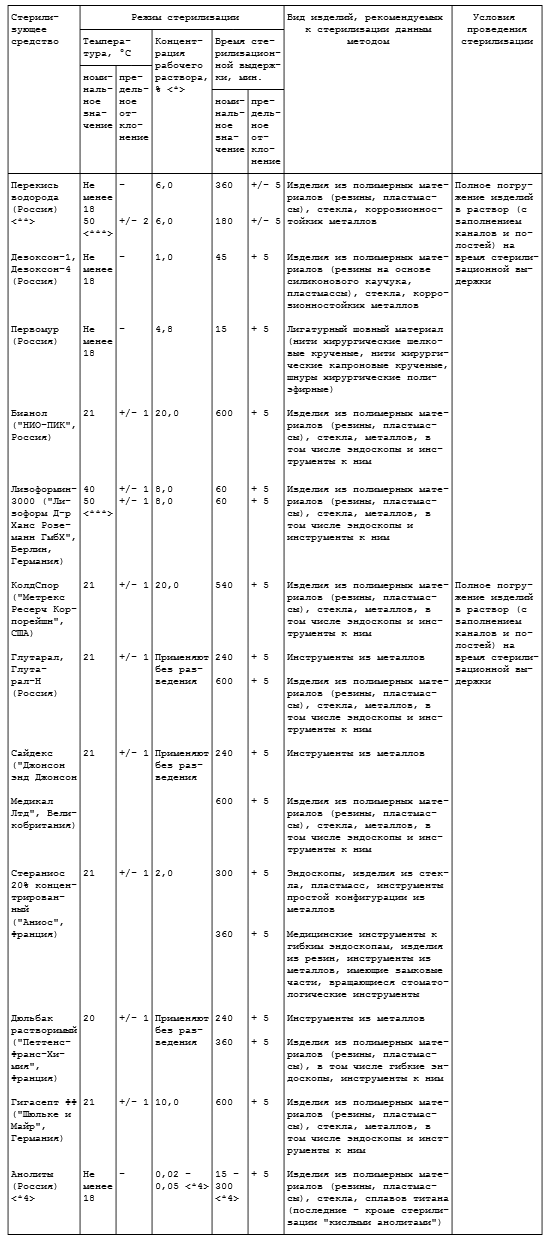
Таблица 4.4
СТЕРИЛИЗАЦИЯ РАСТВОРАМИ ХИМИЧЕСКИХ СРЕДСТВ
--------------------------------
<*> Концентрация растворов средств "Бианол", "Лизоформин-3000", "КолдСпор", "Гигасепт ФФ" приведена по препарату, средства "Первомур" - по суммарному содержанию 30 - 33% перекиси водорода и 100% муравьиной кислоты, растворов остальных средств - по действующему веществу.
<**> Допускается использование только медицинской перекиси водорода.
<***> Температура раствора в момент погружения в него изделий; в процессе стерилизации указанную температуру не поддерживают.
<*4> Электрохимически активированные растворы с pH от 2,0 до 8,4 в зависимости от типа анолита ("кислый анолит", "нейтральный анолит", "нейтральный анолит АНК"), вырабатываемые в установках "ЭХА-30", "СТЭЛ-МТ-1", "СТЭЛ-МТ-2", "СТЭЛ-4Н-60-01", "СТЭЛ-4Н-60-02", "СТЭЛ-10АК-120-01", "СТЭЛ-10Н-120-01". Анолиты используют без разведения. Конкретные режимы стерилизации приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
4.6.3. При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений).
4.6.4. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства "Лизоформин-3000", должна составлять не менее 20 °C для альдегидсодержащих средств и не менее 18 °C - для остальных средств.
4.6.5. Стерилизацию проводят при полном погружении изделий в раствор, свободно их раскладывая. При большой длине изделия его укладывают по спирали. Разъемные изделия стерилизуют в разобранном виде. Каналы и полости заполняют раствором.
4.6.6. Во избежание разбавления рабочих растворов, используемых для стерилизации, погружаемые в них изделия должны быть сухими.
4.6.7. После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают в стерильной жидкости, налитой в стерильные емкости, согласно рекомендациям методического документа по применению конкретного средства. При каждом переносе из одной емкости в другую освобождение каналов и полостей и их заполнение свежей жидкостью осуществляют с помощью стерильного шприца, пипетки или иного приспособления.
4.6.8. Промытые стерильные изделия после удаления остатков жидкости из каналов и полостей используют сразу по назначению или помещают (с помощью стерильных пинцетов, корнцангов) на хранение в стерильную стерилизационную коробку, выложенную стерильной простыней, на срок не более 3 суток.
4.7. Стерилизация газовым методом.
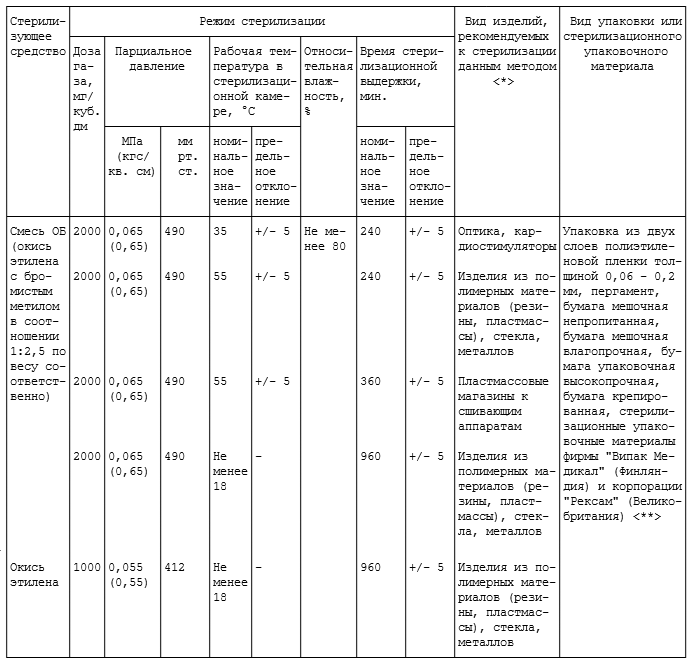
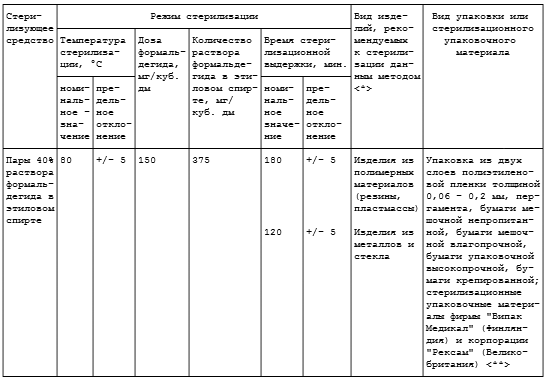
4.7.1. Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте, а также озон.
4.7.2. Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 18 °C), при температуре 35 °C и 55 °C (табл. 4.5), парами раствора формальдегида в этиловом спирте при температуре 80 °C (табл. 4.6). Эндоскопы и медицинские инструменты к гибким эндоскопам стерилизуют согласно режимам, изложенным в соответствующих методических документах (см. Приложение 1).
Таблица 4.5
СТЕРИЛИЗАЦИЯ ГАЗОВЫМ МЕТОДОМ (СМЕСЬ ОБ И ОКИСЬ ЭТИЛЕНА)
--------------------------------
<*> Изделия, простерилизованные смесью ОБ или окисью этилена, применяют после их выдержки в вентилируемом помещении (при скорости движения воздуха 20 см/с) в течение:
- 1 суток - для изделий из стекла, металла;
- 5 - 13 суток - для изделий из полимерных материалов (резин, пластмасс), имеющих кратковременный контакт (до 30 мин.); конкретные сроки проветривания должны быть указаны в ТУ на конкретные изделия;
- 14 суток - для всех изделий, имеющих длительный контакт (свыше 30 мин.) со слизистыми оболочками, тканями, кровью;
- 21 суток - для изделий из полимерных материалов, имеющих длительный контакт (свыше 30 мин.), используемых для детей.
<**> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации газовым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм. Срок сохранения стерильности изделий, простерилизованных в упаковке из полиэтиленовой пленки, - 5 лет, в пергаменте или бумаге - 20 суток.
Таблица 4.6
СТЕРИЛИЗАЦИЯ ГАЗОВЫМ МЕТОДОМ
(ПАРЫ РАСТВОРА ФОРМАЛЬДЕГИДА В ЭТИЛОВОМ СПИРТЕ)
--------------------------------
<*> После стерилизации парами раствора формальдегида в этиловом спирте дегазации изделий из полимерных материалов, металлов и стекла не требуется, за исключением изделий из резин и пластмасс, контактирующих с кровью, для которых требуется дегазация при комнатных условиях в течение двух суток.
<**> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации газовым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм. Срок сохранения стерильности изделий, простерилизованных в упаковке из полиэтиленовой пленки, - 5 лет, в пергаменте или бумаге - 20 суток.
4.7.3. Стерилизацию газовым методом осуществляют в стационарных газовых стерилизаторах, разрешенных к применению в установленном порядке, а также в портативных аппаратах (микроанаэростаты объемом 2,0 куб. дм и 2,7 куб. дм).
Для поддержания температуры стерилизации (35 °C и 55 °C) в портативных аппаратах их помещают в термостат или водяную баню.
4.7.4. Перед газовой стерилизацией изделия после предстерилизационной очистки вытирают чистой салфеткой либо подсушивают при комнатной температуре или температуре 35 °C до исчезновения видимой влаги. Удаление влаги из каналов полимерных (резиновые, пластмассовые) катетеров, трубок проводят с использованием централизованного вакуума, при его отсутствии - с помощью водоструйного насоса, подсоединенного к водопроводному крану.
4.7.5. Изделия после подсушивания упаковывают в разобранном виде в пакеты из рекомендованных упаковочных материалов, затем помещают их в стационарный или в портативный аппарат и закрывают крышкой, которую прижимают зажимом.
4.7.6. При стерилизации смесью ОБ и окисью этилена из портативного аппарата удаляют воздух до давления 0,9 кгс/кв. см, по показанию вакуумметра. Дозирование газов осуществляют по парциальному давлению непосредственно из баллона через штуцер микроанаэростата.
4.7.7. Методика стерилизации изделий медицинского назначения парами раствора формальдегида в этиловом спирте и способ приготовления этого раствора изложены в методических рекомендациях по обработке эндоскопов и медицинских инструментов к гибким эндоскопам (см. Приложение 1).
4.7.8. При использовании портативного аппарата после окончания стерилизационной выдержки его открывают в вытяжном шкафу и выдерживают 5 часов.
4.7.9. Озоном, вырабатываемым в стерилизаторе озоновом СО-01-СПб, стерилизуют инструменты простой конфигурации из коррозионностойких сталей и сплавов, применяемых в хирургии и стоматологии (скальпели, пинцеты, зеркала цельнометаллические, гладилки, зонды, шпатели, боры стоматологические твердосплавные), в неупакованном виде в соответствии с методическим документом по применению данного средства (см. Приложение 1).
После стерилизации инструменты используют по назначению сразу (без дополнительного проветривания).
4.8. Стерилизация аппаратов экстракорпорального (искусственного) кровообращения.
4.8.1. Аппараты искусственного кровообращения стерилизуют в разобранном и в собранном виде. Подготовка аппарата к стерилизации предусматривает все этапы предстерилизационной очистки (табл. 3.2).
4.8.2. Отдельные блоки и детали аппарата (оксигенераторы, резервуар для донорской крови, резервный сосуд, артериальные канюли, венозные катетеры, тройник, ловушки, трубки из полимерных материалов и т.д.) стерилизуют паровым методом при температуре 120 - 122 °C.
Трубки из полимерных материалов, при стерилизации приобретают молочный цвет, исчезающий после подсушивания в сушильном шкафу при температуре 60 - 80 °C в течение 10 часов. Сборку аппарата осуществляют в асептических условиях.
4.8.3. Стерилизацию аппаратов экстракорпорального кровообращения в собранном виде проводят газовым методом с применением окиси этилена согласно методическому документу по стерилизации аппаратов искусственного кровообращения (см. Приложение 1).
4.9. Контроль стерилизации.
4.9.1. Контроль стерилизации предусматривает проверку параметров режимов стерилизации и оценку ее эффективности. Более подробно вопросы контроля стерилизации изложены в ряде официальных инструктивно-методических документов, указанных в Приложении 1.
4.9.2. Контроль параметров режимов стерилизации проводят физическим (с помощью контрольно-измерительных приборов: термометров, мановакуумметров и др.) и химическим (с использованием химических индикаторов) методами.
4.9.3. Контроль работы паровых и воздушных стерилизаторов проводят с учетом сведений, приведенных в Приложении 5.
4.9.4. Эффективность стерилизации оценивают на основании результатов бактериологических исследований, проводимых при применении биотестов (Приложение 5) и контроле стерильности изделий, подвергнутых стерилизации (Приложение 6).
5. МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С ДЕЗИНФИЦИРУЮЩИМИ,
МОЮЩИМИ И СТЕРИЛИЗУЮЩИМИ СРЕДСТВАМИ
5.1. К работе со средствами не допускаются лица моложе 18 лет, страдающие аллергическими заболеваниями, беременные женщины и кормящие матери.
5.2. Приготовление рабочих растворов средств, дезинфекцию, предстерилизационную очистку и стерилизацию изделий медицинского назначения проводят в специальном помещении с естественной или искусственной приточно-вытяжной вентиляцией.
5.3. Емкости с рабочими растворами в процессе обработки должны быть плотно закрыты крышками. Все работы со средствами выполнять в резиновых перчатках.
5.4. Если в методических указаниях по применению средства имеются рекомендации по защите органов дыхания респираторами (РУ-60М или РПГ-68), следует неукоснительно их соблюдать.
5.5. После окончания работ со средствами помещение проветрить.
5.6. Хранить средства в отдельном помещении, в прохладном месте, закрытыми в шкафу отдельно от лекарственных препаратов, в местах, недоступных детям.
Приложение 1
ПЕРЕЧЕНЬ
ИНСТРУКТИВНО-МЕТОДИЧЕСКИХ ДОКУМЕНТОВ, ОТРАЖАЮЩИХ ВОПРОСЫ
ДЕЗИНФЕКЦИИ, ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКИ И СТЕРИЛИЗАЦИИ
ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ

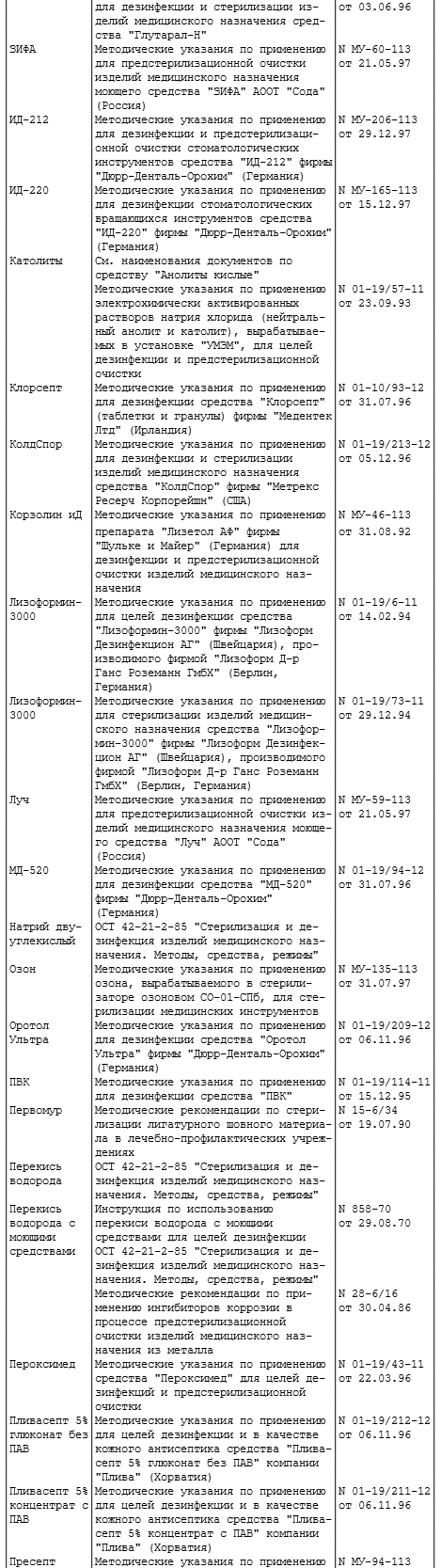
1. ОСТ 42-21-2-85 "Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы".
2. Приказ Минздрава СССР от 12 июля 1989 г. N 408 "О мерах по снижению заболеваемости вирусными гепатитами в стране".
3. Приказ Минздрава России от 16 июня 1997 г. N 184 "Об утверждении Методических указаний по очистке, дезинфекции и стерилизации эндоскопов и инструментов к ним, используемых в лечебно-профилактических учреждениях".
4. Методические указания по классификации очагов туберкулезной инфекции, проведению и контролю качества дезинфекционных мероприятий при туберкулезе (N 10-8/39 от 04.05.79).
5. Методические рекомендации по дезинфекции, предстерилизационной очистке и стерилизации медицинских инструментов к гибким эндоскопам (N 28-6/3 от 09.02.88).
6. Методические рекомендации по очистке, дезинфекции и стерилизации эндоскопов (N 15-6/33 от 17.07.90).
7. Методические рекомендации по стерилизации лигатурного шовного материала в лечебно-профилактических учреждениях (N 15-6/34 от 19.07.90).
8. Методические указания по контролю работы паровых и воздушных стерилизаторов (N 15/6-5 от 28.02.91).
9. Методические указания по применению озона, вырабатываемого в стерилизаторе озоновом СО-01-СПб, для стерилизации медицинских инструментов (N МУ-135-113 от 31.07.97).
10. Методические рекомендации по стерилизации аппаратов искусственного кровообращения газообразной окисью этилена (N 1013-73 от 26.03.72).
11. Методические указания по применению медицинских упаковочных материалов корпорации "Рексам" (Великобритания) (N МУ-204-113 от 29.12.97).
12. Методические указания по применению медицинских упаковочных материалов "Стерикинг" фирмы "Випак Медикал" (Финляндия) (N МУ-157-113 от 10.08.98).
13. Инструкция по применению индикаторов стерилизации одноразового применения ИС-120, ИС-132, ИС-160, ИС-180 (N 154.004.98 ИП от 18.02.98).
Приложение 2
ПЕРЕЧЕНЬ
ДЕЗИНФЕКЦИОННЫХ СРЕДСТВ И МЕТОДИЧЕСКИХ
ДОКУМЕНТОВ ПО ИХ ПРИМЕНЕНИЮ
Приложение 3
КОНТРОЛЬ КАЧЕСТВА ДЕЗИНФЕКЦИИ ИЗДЕЛИЙ
МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. О качестве дезинфекции после ее проведения судят по отсутствию на изделиях медицинского назначения золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки. Контролю подлежит 1% от одновременно обработанных изделий одного наименования, но не менее 3 - 5 единиц.
2. Контроль качества дезинфекции осуществляют методом смывов. Взятие смывов производят с поверхностей изделий медицинского назначения до проведения дезинфекции и после нее. Взятие смывов производят стерильными марлевыми салфетками размером 5 х 5 см, простерилизованными в бумажных пакетах или чашках Петри.
3. Перед взятием смывов с объектов в стерильные широкогорлые пробирки со стеклянными бусами стерильной пипеткой разливают по 10 мл стерильной водопроводной воды или нейтрализатора, соответствующего применяемому дезинфицирующему средству: для группы окислителей (хлор, йод, перекисьсодержащие средства) - 0,5 - 1% раствор тиосульфата натрия; для катионных ПАВ - 0,5% раствор сульфонола; для альдегид - и фенолсодержащих средств - вода; для композиционных средств - универсальный нейтрализатор, содержащий твин-80, - 3%, сапонин - 3%, гистидин - 0,1%, цистеин - 0,1%. Салфетку захватывают стерильным пинцетом, увлажняют стерильной водопроводной водой из пробирки и протирают ею поверхность обрабатываемого изделия. После этого салфетку помещают в пробирку с водой и затем встряхивают в течение 5 мин., избегая увлажнения пробки.
4. У изделий, имеющих функциональные каналы, рабочий конец изделия опускают в пробирку со стерильной водопроводной водой или нейтрализатором и с помощью стерильного шприца или пипетки 1 - 2 раза промывают канал этим раствором.
5. Смывы по 0,1 мл наносят на поверхность желточно-солевого, кровяного агара и на среду Эндо. Посевы выдерживают в термостате при температуре 37 °C. Результаты учитывают через 48 часов.
6. При наличии роста микроорганизмов на агаре идентификацию выделенных микроорганизмов проводят в соответствии с действующими методическими документами. Дезинфекцию считают эффективной при отсутствии роста микроорганизмов, указанных в п. 1.
Приложение 4
КОНТРОЛЬ КАЧЕСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКИ ИЗДЕЛИЙ
МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. Контроль качества предстерилизационной очистки проводят центры Государственного санитарно-эпидемиологического надзора и дезинфекционные станции не реже 1 раза в квартал.
Самоконтроль в ЛПУ проводят: в централизованных стерилизационных (ЦС) ежедневно, в отделениях - не реже 1 раза в неделю; организует и контролирует его старшая медицинская сестра (акушерка) ЦС (отделения).
2. Контролю подлежит: в ЦС - 1% от каждого наименования изделий, обработанных за смену, в отделениях - 1% одновременно обработанных изделий каждого наименования, но не менее 3 единиц.
3. Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой или амидопириновой пробы на наличие остаточных количеств крови, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств.
4. Методика приготовления реактивов для постановки проб.
4.1. Азопирамовая проба.
4.1.1. Приготовление исходного раствора.
Для приготовления 1 л (куб. дм) исходного раствора азопирама отвешивают 100 г амидопирина и 1,0 - 1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (куб. дм) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения исходного раствора азопирама составляет: при температуре 4 °C (в холодильнике) - 2 месяца; при комнатной температуре (20 +/- 2 °C) - не более 1 месяца. Умеренное пожелтение исходного раствора без выпадения осадка в процессе хранения не снижает рабочих свойств раствора.
4.1.2. Приготовление реактива азопирам.
Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водорода.
Реактив азопирам можно хранить не более 2 часов. При более длительном стоянии может появиться спонтанное розовое окрашивание реактива. При температуре выше +25 °C раствор розовеет быстрее, поэтому его необходимо использовать в течение 30 - 40 мин. Не следует подвергать проверке горячие инструменты, а также хранить реактив азопирам на ярком свету и вблизи нагревательных приборов.
В случае необходимости, пригодность реактива азопирам проверяют следующим образом: 2 - 3 капли реактива наносят на пятно крови. Если не позже чем через 1 мин. появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению; если окрашивание в течение 1 мин. не появляется, реактивом пользоваться не следует.
4.2. Амидопириновая проба.
Готовят 5% спиртовой раствор амидопирина на 95% этиловом спирте. Данный раствор должен храниться во флаконе с притертой пробкой в холодильнике; срок годности раствора - 1 месяц.
Готовят 30% раствор уксусной кислоты и 3% раствор перекиси водорода на дистиллированной воде.
Смешивают равные количества 5% спиртового раствора амидопирина, 30% раствора уксусной кислоты и 3% раствора перекиси водорода. Реактив готовят перед применением.
4.3. Фенолфталеиновая проба.
Готовят 1% спиртовой раствор фенолфталеина на 95% этиловом спирте; раствор хранят во флаконе с притертой пробкой в холодильнике в течение месяца.
5. Методика постановки проб.
Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом, или наносят 2 - 3 капли реактива на изделие с помощью пипетки.
В шприцы вносят 3 - 4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить реактивом внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь; реактив оставляют в шприце на 1 мин., а затем вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый, не имеющий следов коррозии шприц. Последовательно меняя иглы, через них пропускают реактив, вытесняя 3 - 4 капли на марлевую салфетку.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия на 1 мин., после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от его величины.
6. Учет результатов постановки проб.
При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее чем через 1 мин. появляется вначале фиолетовое, затем быстро, в течение нескольких секунд, переходящее в розово-сиреневое или буроватое окрашивание реактива.
Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств пероксидоз растительного происхождения (растительных остатков), окислителей (хлорамина, хлорной извести, стирального порошка с отбеливателем, хромовой смеси для обработки посуды и др.), а также ржавчины (окислов и солей железа) и кислот. При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово-сиреневый цвет.
При положительной амидопириновой пробе о наличии на изделиях остаточных количеств крови свидетельствует немедленное или не позже чем через 1 мин. после контакта реактива с кровью появление сине-фиолетового окрашивания различной интенсивности.
При постановке азопирамовой и амидопириновой проб окрашивание реактивов, наступившее позже чем через 1 мин. после постановки пробы, не учитывается.
При положительной фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных компонентов моющего средства свидетельствует появление розового окрашивания реактива.
В случае положительной пробы на кровь или на остаточные количества щелочных компонентов моющих средств всю группу контролируемых изделий, из которой отбирали контроль, подвергают повторной очистке до получения отрицательных результатов.
Результаты контроля отражают в журнале по форме N 366/у (табл. П.4.1).
Таблица П.4.1
Код формы по ОКУД
Код учреждения по ОКПО
Приложение 5
КОНТРОЛЬ РАБОТЫ ПАРОВЫХ И ВОЗДУШНЫХ СТЕРИЛИЗАТОРОВ
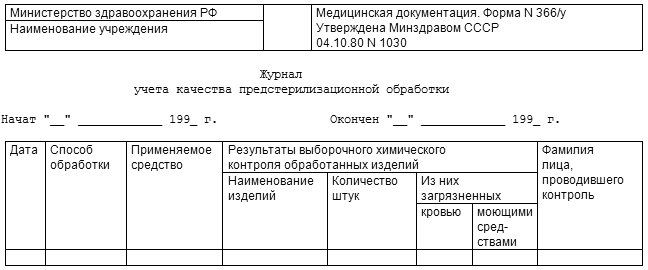
Методы и средства контроля работы паровых и воздушных стерилизаторов представлены в таблице П.5.1.
Проверку температурного режима осуществляют с помощью максимальных термометров, которые помещают в контрольные точки стерилизаторов в соответствии с таблицей П.5.2 (паровые стерилизаторы) и таблицей П.5.3 (воздушные стерилизаторы). Предельные отклонения температуры в различных точках стерилизационной камеры от номинальных значений температур стерилизации должны соответствовать показателям, приведенным в таблице 4.1 (паровые стерилизаторы) и таблице 4.2 (воздушные стерилизаторы) данных Методических указаний.
Для контроля температуры используют также химические индикаторы (индикаторы типа НС, химические тесты), которые помещают в контрольные точки, указанные выше.
Индикаторы типа ИС представляют собой полоску бумаги с нанесенным на нее индикаторным слоем.
Химические тесты представляют собой стеклянные трубки, содержащие химические соединения или их смеси с красителями.
Указанные средства химического контроля свидетельствуют о достижении заданной температуры по изменению агрегатного состояния и/или цвета химических соединений, наблюдаемому после окончания стерилизации.
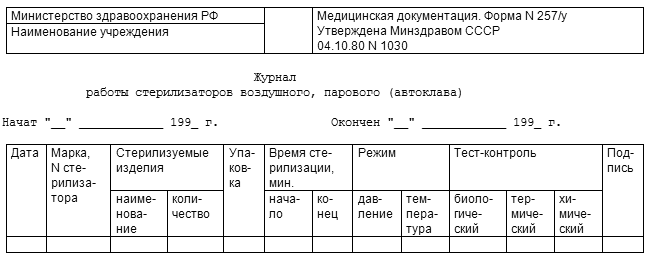
Медицинский персонал, использующий средства физического и химического контроля, регистрирует результаты контроля в журнале по форме N 257/у (табл. П.5.4).
Бактериологический контроль работы стерилизационной аппаратуры осуществляют с помощью биотестов, оценивая гибель спор термоустойчивых микроорганизмов. Биотесты представляют собой дозированное количество спор тест-культуры (табл. П.5.1) на носителе (или в нем), помещенном в упаковку, которая предназначена для сохранения целостности носителя со спорами и предупреждения вторичного обсеменения после стерилизации. В качестве носителей используют инсулиновые флаконы, чашечки из алюминиевой фольги (для паровых и воздушных стерилизаторов), а также диски из фильтровальной бумаги (для воздушных стерилизаторов). Упакованные биотесты помещают в те же контрольные точки стерилизационной камеры, что и средства физического и химического контроля.
Основанием для заключения об эффективной работе стерилизационной аппаратуры является отсутствие роста тест-культуры при бактериологических исследованиях всех биотестов в сочетании с удовлетворительными результатами физического и химического контроля.
Таблица П.5.1
КОНТРОЛЬ РАБОТЫ ПАРОВЫХ И ВОЗДУШНЫХ СТЕРИЛИЗАТОРОВ
--------------------------------
<*> Изменение цвета химических индикаторов после цикла стерилизации не является свидетельством достижения стерильности изделий.
Примечание: Знак "-" обозначает, что данный показатель не контролируется или данное средство контроля не используется для этого режима.
Таблица П.5.2
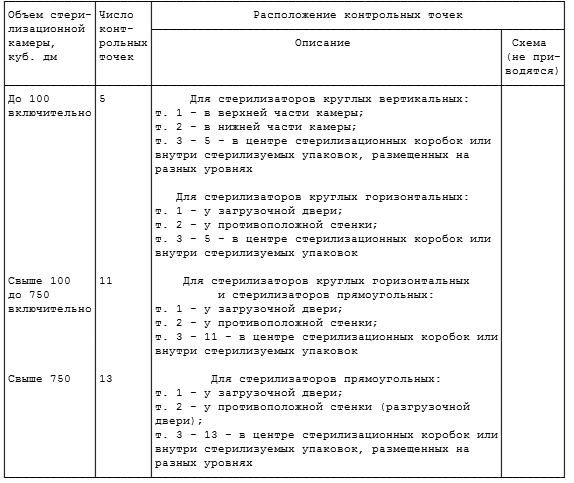
РАСПОЛОЖЕНИЕ КОНТРОЛЬНЫХ ТОЧЕК В ПАРОВЫХ СТЕРИЛИЗАТОРАХ
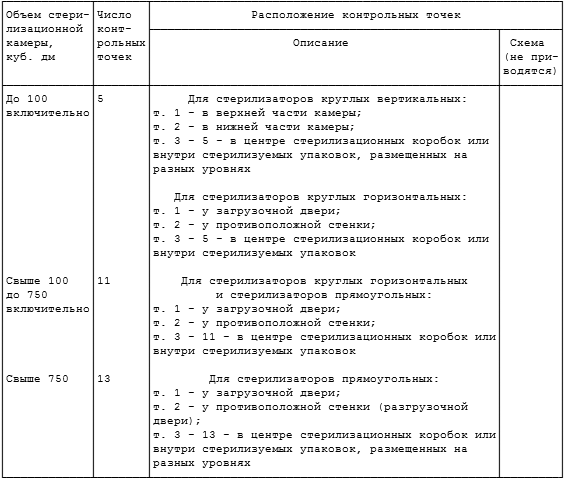
Примечание. Контрольные тесты помещают на расстоянии не менее 5 см от стенок стерилизационной камеры.
Таблица П.5.3
РАСПОЛОЖЕНИЕ КОНТРОЛЬНЫХ ТОЧЕК В ВОЗДУШНЫХ СТЕРИЛИЗАТОРАХ

Таблица П.5.4
Код формы по ОКУД
Приложение 6
КОНТРОЛЬ СТЕРИЛЬНОСТИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. Требования к помещению для посева на стерильность.
1.1. Контроль стерильности изделий, простерилизованных в ЛПУ, проводят в специально оборудованных помещениях, соблюдая асептические условия, исключающие возможность вторичной контаминации изделий микроорганизмами.
Посев исследуемого материала желательно проводить в настольных боксах с ламинарным потоком воздуха.
При их отсутствии контроль стерильности проводят в боксированных помещениях (бокс с предбоксником). Общая площадь бокса должна быть не менее 3 кв. м.
1.2. В боксированном помещении стены должны быть окрашены масляной краской или выложены кафельной плиткой, не должны иметь выступов, карнизов, щелей, трещин; пол в боксе и рабочий стол должны быть покрыты линолеумом или другим гладким, легко моющимся и устойчивым к действию дезинфицирующих средств материалом; стенки и ножки стола должны быть окрашены масляной краской.
1.3. Боксы оборудуют приточно-вытяжной вентиляцией (с преобладанием притока над вытяжкой) с подачей в них воздуха через бактериальные фильтры.
1.4. В боксе и предбокснике устанавливают бактерицидные облучатели в соответствии с нормами, предусмотренными действующими инструктивно-методическими документами (Руководство Р.3.1.683-98 "Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха и поверхностей в помещениях").
2. Подготовка бокса, инструментов и персонала к работе.
2.1. Перед проведением работы поверхности в помещениях бокса и предбоксника (стены, пол, оборудование и др.), а также внутренние поверхности настольного бокса протирают 3% раствором перекиси водорода с 0,5% раствором моющего средства. В случае обнаружения в воздухе грибов или спорообразующих микроорганизмов обработку проводят 6% раствором перекиси водорода с 0,5% раствором моющего средства или 6% раствором средства "Пероксимед", или 2% раствором средства "ПВК" (концентрации приведены по ДВ).
Через 45 - 60 мин. после обработки в бокс вносят все необходимые для работы материалы и инструменты, кроме образцов изделий.
2.2. При проведении работы в настольном боксе в нем включают вентиляцию на время, достаточное для обеспечения полного обмена воздуха, а затем помещают необходимый для работы материал.
2.3. В боксе и предбокснике перед работой включают бактерицидные облучатели. Длительность облучения определяют в соответствии с документом, упомянутым в п. 1.4.
2.4. Вспомогательные инструменты и лабораторную посуду, используемые в работе, а также спецодежду предварительно стерилизуют. В процессе работы вспомогательные инструменты 2 - 3 раза заменяют аналогичным стерильным комплектом.
Внутреннюю поверхность настольного бокса обрабатывают так же, как и помещение бокса. Через 45 - 60 мин. после обработки в бокс вносят все необходимые для работы материалы и инструменты, кроме образцов изделий.
2.5. Перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом, вытирают их стерильным полотенцем (салфеткой), надевают в предбокснике бахилы, стерильные халаты, 4-слойные маски, шапочки и стерильные перчатки.
2.6. В процессе работы в боксе проверяют обсемененность воздуха. Для этого на рабочий стол ставят 2 чашки с питательным агаром, открывая их на 15 мин., затем чашки помещают в термостат при температуре 32 °C на 48 часов.
Допускается рост не более трех колоний неспорообразующих сапрофитов на чашке.
В случае роста более трех колоний дополнительно проводят обработку бокса 6% раствором перекиси водорода с 0,5% раствором моющего средства или 6% раствором средства "Пероксимед", или 2% раствором средства "ПВК".
3. Правила отбора проб.
3.1. В стационарах, имеющих централизованные стерилизационные, контролю на стерильность подлежит не менее 1% от числа одновременно простерилизованных изделий одного наименования.
3.2. В стационарах, не имеющих централизованных стерилизационных и осуществляющих стерилизацию в отделениях, контролю на стерильность подлежат не менее двух одновременно простерилизованных изделий одного наименования.
3.3. Отбор проб на стерильность проводит лаборант центра Госсанэпиднадзора, дезинфекционной станции или медицинская сестра под руководством сотрудника бактериологической лаборатории.
3.4. При стерилизации изделий в упакованном виде (централизованная и децентрализованная стерилизация) все изделия, подлежащие контролю, направляют в бактериологическую лабораторию в упаковке, в которой осуществляли их стерилизацию. Перед доставкой в лабораторию стерильные изделия в упаковке дополнительно заворачивают в стерильную простыню или помещают в наволочку.
При стерилизации изделий в неупакованном виде в отделении отбор проб проводят в стерильные емкости, соблюдая правила асептики.
После проведения контроля стерильности все изделия, за исключением перевязочных материалов, подлежат обязательному возврату для последующего использования.
4. Методика и техника посева на стерильность.
4.1. Посевы на стерильность проводит бактериолог с помощью лаборанта.
4.2. Перед посевом исследуемый материал вносят в предбоксник, предварительно сняв наружную мягкую упаковку. В предбокснике с помощью стерильного пинцета (корнцанга) стерилизационные коробки, пакеты протирают снаружи стерильной салфеткой (ватным тампоном), смоченной 6% раствором перекиси водорода, перекладывают на стерильный лоток и оставляют на 30 мин., затем переносят в бокс. При поступлении изделий, упакованных в два слоя бумаги, пергамента, ткани, первый слой снимают в предбокснике и изделия во внутренней упаковке переносят в бокс.
4.3. В боксе с помощью стерильного пинцета изделия извлекают из стерилизационной коробки, пакета или другой упаковки.
4.4. Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или в виде отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды. Объем питательной среды в пробирке (колбе, флаконе) должен быть достаточным для полного погружения изделия (деталей или фрагментов изделия).
При проверке стерильности более крупных изделий проводят отбор проб методом смывов с различных участков поверхности изделий: с помощью стерильного пинцета (корнцанга) каждый участок тщательно протирают марлевой салфеткой (размер салфетки 5 х 5 см), увлажненной стерильной питьевой водой или стерильным 0,9% раствором хлорида натрия, или раствором нейтрализатора (при стерилизации раствором химического средства). Каждую салфетку помещают в отдельную пробирку с питательной средой.
У изделий, имеющих функциональные каналы, рабочий конец опускают в пробирку с питательной средой и с помощью стерильного шприца или пипетки 1 - 2 раза промывают канал этой средой.
4.5. При контроле стерильности проводят посев на тиогликолевую среду (сухая питательная среда для контроля стерильности НИИВС им. И.И. Мечникова) и среду Сабуро. Состав сред и способ их приготовления приведены в приложении N 1 к Приказу Минздрава СССР от 31 июля 1978 г. N 720 "Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилении мероприятий по борьбе с внутрибольничной инфекцией" (тиогликолевую среду из сухой питательной среды готовят способом, указанным на этикетке).
При контроле изделий каждого наименования обязателен одновременный посев на обе указанные питательные среды.
На пробирках, колбах и флаконах с посевами делают надписи с указанием даты посева, номеров загрузки и образца.
4.6. Посевы в тиогликолевую среду выдерживают в термостате при температуре 32 °C, посевы в среду Сабуро - при температуре 20 - 22 °C в течение 14 суток при контроле изделий, простерилизованных растворами химических средств и газовым методом, в течение 7 суток - изделий, простерилизованных термическими (паровой, воздушный) методами.
4.7. При отсутствии роста микроорганизмов во всех пробирках (колбах, флаконах) делают заключение о стерильности изделий.




